Por Jéssica Portal Maia* e Kamyle Medina Monte Rey**
Com a pandemia causada pelo Covid-19, a telemedicina, que há anos tem sido foco de discussões a respeito de sua regulamentação, voltou a ser colocada em pauta como uma alternativa para atender a população, reduzindo o risco à exposição e ao contágio em ambientes hospitalares ou em clínicas.
Foi realizado benchmarking internacional sobre as regulações que impactam a telemedicina no Brasil, nos EUA e na União Europeia (UE) (com enfoque nos países-membros Alemanha, Bélgica, França e Itália). Tais normativos foram agrupados de acordo com o principal tema abordado e com o seu período de vigência; e classificados segundo o tipo de instrumento regulatório. Em seguida, realizou-se análise setorial de impacto concorrencial baseado no Checklist de Concorrência da OCDE (2017).
O primeiro tema a ser abordado trata da comparação das regulações voltadas à telemedicina, conforme o Quadro 1:
Quadro 1. Comparativo das regulações relacionadas à telemedicina: UE (países selecionados), EUA e Brasil
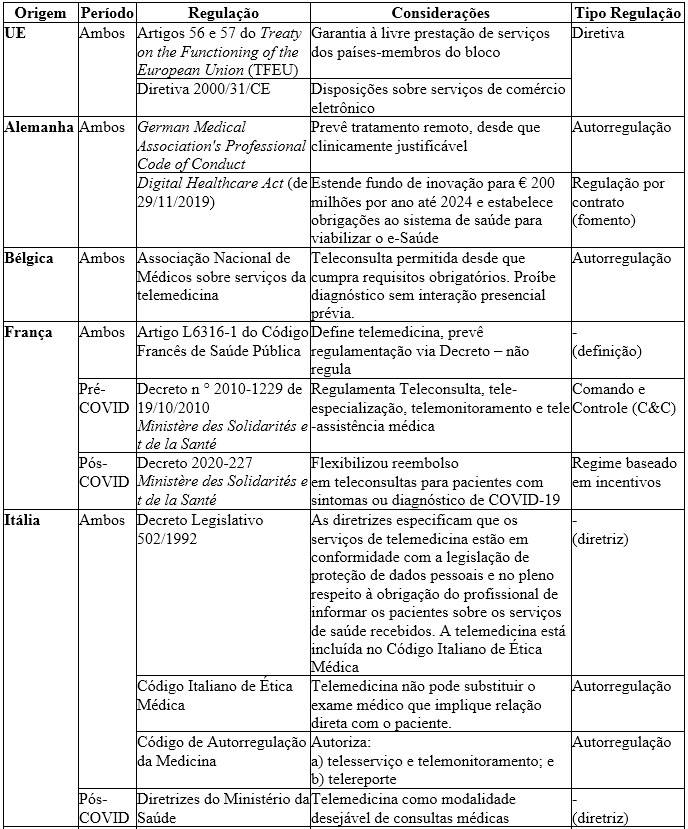

A União Europeia possui legitimidade limitada para atuar sobre o setor de saúde, assim, os normativos identificados no âmbito do bloco são voltados à garantia de prestação de serviços em todos os estados-membros, e, portanto, não se identificou impacto concorrencial relevante sobre o tema. A regulação específica é definida em cada país membro.
Na Alemanha, a previsão da telemedicina foi estabelecida pela German Medical Association, com a possibilidade de atendimento remoto, desde que seja clinicamente justificável, o que constitui uma forma de autorregulação do mercado. Adicionalmente, o Digital Healthcare Act pode ser enquadrado como uma forma de regulação por contrato, uma vez que objetiva fomentar o desenvolvimento do setor com imposição de parâmetros regulatórios, instrumento que também encoraja o desenvolvimento da autorregulação e da meta-regulação. Esses mecanismos por sua vez, têm o potencial de contribuir para a redução de assimetrias informacionais entre regulador e regulado e para um aumento de eficiência, sendo, a priori, concorrencialmente favoráveis. Entretanto, em setores com maior poder de mercado, há riscos de comportamentos colusivos e captura dos agentes públicos, o que pode reforçar a concentração do setor em análise. Assim, para evitar os possíveis riscos decorrentes da autorregulação, é recomendável monitorar o grau de concentração do mercado de telemedicina e adotar medidas de accountability.
Na Bélgica e na Itália, também foram identificadas formas de autorregulação sobre o setor de telemedicina, determinadas pela Associação Nacional de Médicos e pelo Código de Autorregulação da Medicina, respectivamente. Entretanto, ressalta-se o estabelecimento de medidas restritivas aos serviços de teleconsulta, ao impossibilitar a atribuição de um diagnóstico sem interação presencial prévia no caso belga; e a delimitar os tipos de serviços autorizados a telesserviço, a telemonitoramento e a telereporte no caso italiano, sem previsão de incluir a teleconsulta até agora. Tais medidas apontam para uma postura mais conservadora desses agentes, estabelecendo barreiras regulatórias à disseminação da telemedicina, o que pode constituir um indício das falhas regulatórias atreladas ao instrumento da autorregulação, contribuindo assim para redução da competitividade entre os prestadores de serviços de assistência à saúde.
Diante do exposto, é possível enquadrar as regulações adotadas pela Bélgica e pela Itália com potencial redução do incentivo das empresas a competir, decorrente do estabelecimento de um regime de autorregulação (C3). No caso alemão, a priori, não há evidências suficientes para a identificação de efeitos anticoncorrenciais decorrentes dos instrumentos regulatórios adotados.
No caso da França, os regulamentos sobre a telemedicina foram estabelecidos pelo Ministère des Solidarités et de la Santé. O Decreto n° 2010-1229, de 19/10/2010, pode ser enquadrado como uma regulamentação de comando e controle (C&C), em vista da determinação sobre quais serviços são autorizados e seus respectivos requisitos de funcionamento. A vantagem dessa estratégia se dá pelo estabelecimento de um posicionamento claro com eficácia imediata e proibições em caso de não cumprimento, porém, ressaltam-se os possíveis riscos desse instrumento que possam impactar negativamente a concorrência, tais como rigidez excessiva da regulação para cumprir o objetivo inicial, decorrente da assimetria de informações por parte do regulador.
No caso dos EUA, as regulações voltadas para a telemedicina são definidas em nível estadual. A falta de uma diretriz nacional pode criar barreiras regulatórias para a disseminação dos serviços relacionados no país, incorrendo em efeitos concorrenciais potencialmente negativos. No entanto, não foram identificadas evidências suficientes para analisar o impacto sobre a concorrência neste cenário. Enfim, no Brasil, antes do contexto da pandemia, a telemedicina era regulada pelo Conselho Federal de Medicina, criado pela Lei nº 3.268/1957, no qual, em conjunto com os Conselhos Regionais de Medicina, constitui uma autarquia de direito público, com autonomia administrativa e financeira. Portanto, a Resolução CFM nº 1.643/2002, que regulamenta esse tema, pode ser enquadrada como medida de comando e controle. Entretanto, esta norma não prevê regulamentação dos serviços relacionados à telemedicina. Com isso, pontua-se o risco intrínseco ao C&C de captura do regulador, sendo recomendável a ampliação de medidas de enforcement para evitar sua concretização.
O contexto de pandemia não alterou a regulação aplicada na Alemanha, o que pode ser apontado como evidência de que os instrumentos aplicados foram efetivos para um ambiente de negócios favorável à disseminação da telemedicina no país. Na Itália, o governo disponibilizou apenas diretrizes com recomendações à adoção da teleconsulta, no entanto, essa modalidade não foi regulamentada até o momento. No caso do Brasil, o Ministério da Saúde definiu requisitos para viabilizar os serviços da telemedicina, mas em caráter provisório. Além disso, a Lei nº 13.989/2020 garantiu competência sobre a telemedicina após a pandemia, mas até o momento, não houve alteração na Resolução CFM vigente. Diante disso, destaca-se que o atual cenário de insegurança jurídica pode prejudicar a sua disseminação.
O segundo tema apresentado é voltado às licenças para exercício da telemedicina. Os
resultados encontrados foram apresentados no Quadro 2:
Quadro 2. Comparativo das regulações relacionadas às licenças para o exercício da telemedicina: EU, EUA e Brasil
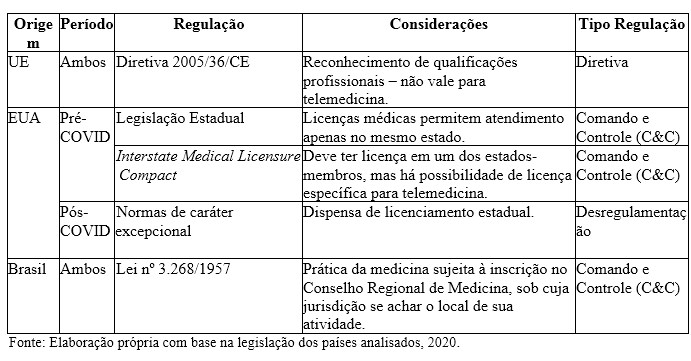
Fonte: Elaboração própria com base na legislação dos países analisados, 2020.
Ressalta-se que, no Brasil e nos EUA, em período anterior à pandemia, as regulamentações aplicadas eram de comando e controle, que, neste caso, podem ser justificadas pela necessidade de estabelecimento de critérios claros para a permissão do exercício da medicina, haja vista o seu impacto direto sobre a saúde dos indivíduos.
A regulação prevista pela União Europeia tem caráter diretivo, porém, a Diretiva 2005/36/CE, que estabelece os critérios para reconhecimento da qualificação profissional não abarca a telemedicina, destacando-se a limitação da sua legitimidade para regular sobre o setor de saúde.
O advento da telemedicina ressaltou possíveis efeitos anticoncorrenciais relacionados à aprovação dessas licenças, especialmente nos casos dos EUA e do Brasil, que, no cenário anterior à Covid, contribuíram para o estabelecimento de uma reserva de mercado para médicos com licenças em estados específicos, impedindo sua atuação em outros estados que pudessem demandar seus serviços, gerando uma possível ineficiência na alocação dos serviços de assistência à saúde e maior poder de mercado dos prestadores. No caso da UE, os requisitos para atribuição da licença médica, ainda que esta tenha validade em todos os estados-membros, não permitem o exercício da telemedicina. As dificuldades apontadas são relacionadas à: a) definição do idioma a ser adotado; b) definição de quem tem competência para regular o tema, devido à legitimidade limitada da UE no setor de saúde; e c) compatibilidade dos registros eletrônicos de saúde.
O contexto da Covid-19 alterou a abordagem dos EUA sobre o tema de forma provisória, o que contribuiu para a disseminação da telemedicina no atual contexto de pandemia e para o aumento da competitividade nesse mercado. Entretanto, o caráter provisório da alteração pode impactar o setor em momento posterior, considerando a incorporação tecnológica para aumentar o acesso e os demais benefícios relacionados aos planos privados de assistência à saúde.
Diante disso, entende-se que a regulação acerca da qualificação médica nas origens levantadas enquadra-se no cenário A2 (limitação do número ou da variedade de fornecedores), a partir do estabelecimento de um regime de licenciamento ou de autorização como requisito de atividade, com exigências que potencialmente ultrapassam o necessário para garantir a segurança e qualidade da assistência prestada pelos médicos.
O terceiro tema em análise está voltado para a possibilidade de prescrição à distância, com o arcabouço regulatório identificado sobre o tema resumido no Quadro 3:
Quadro 3. Comparativo das regulações relacionadas à possibilidade de prescrição à distância: EU (países selecionados), EUA e Brasil
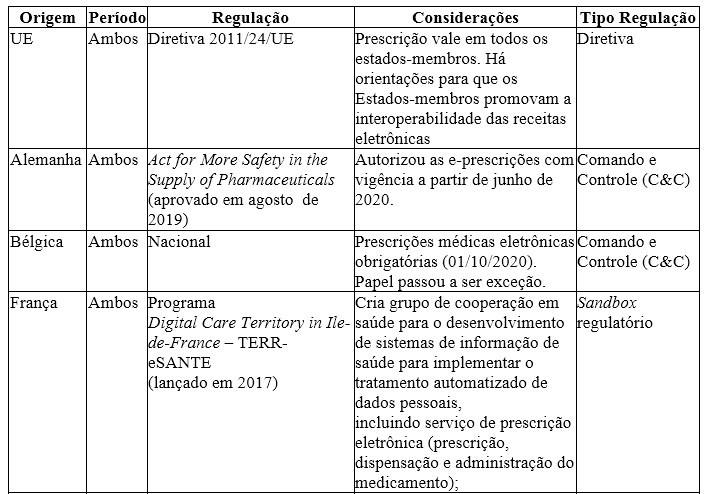
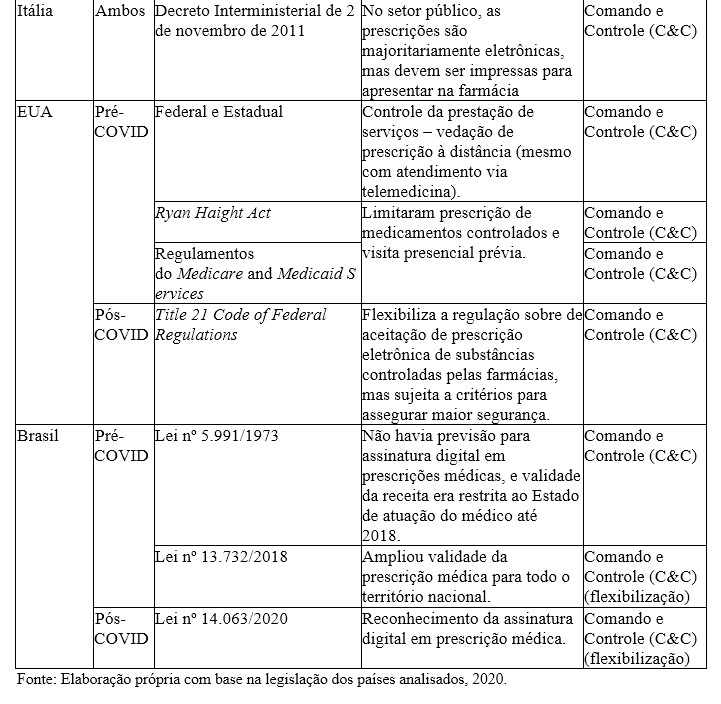
No caso da União Europeia, o tema foi tratado pela Diretiva 2011/24/UE, que dispõe explicitamente sobre a eliminação de barreiras regulatórias e administrativas para reconhecimento da prescrição médica em todos os países membros, o que contribui para uma maior eficiência na assistência à saúde prestada. Destaca-se que esse instrumento define as diretrizes sobre os resultados esperados, sem estabelecer de forma rígida qual mecanismo cada estado-membro deve adotar para alcançá-los.
Na Alemanha, o Act for More Safety in the Supply of Pharmaceuticals autorizou as prescrições eletrônicas com vigência a partir de junho de 2020. Na Bélgica, as prescrições eletrônicas passaram a ter caráter obrigatório em 1º de janeiro de 2020, com a opção de papel definida como exceção em casos sem a opção digital. No caso da França, foi estabelecido um programa de caráter experimental para a circulação de prescrições eletrônicas, caracterizado como um sandbox regulatório, que consiste em um instrumento de cooperação entre o regulador e a indústria regulada para testar projetos inovadores segundo requisitos regulatórios específicos, com objetivo de impulsionar a inovação e reduzir a assimetria informacional entre os agentes. Na Itália, em 2011, foi publicado o Decreto Interministerial entre o Ministério da Saúde e o Ministério da Economia italianos com autorização para a adoção de prescrições eletrônicas. Diante do exposto, em relação ao mercado de telemedicina, não foram identificados impactos concorrenciais relevantes sobre os instrumentos regulatórios adotados por estes países europeus.
No caso do Brasil, até 2018, as barreiras sobre a validade da receita médica apenas no estado em que foi prestado atendimento impunham custos adicionais aos indivíduos que se deslocaram para outro estado. Isso ocorria em virtude da necessidade de agendamento com médico local para conseguir a mesma prescrição, sujeitando-se à disponibilidade de atendimento no curto prazo, o que pode colocar em risco inclusive a continuidade do tratamento de uma doença crônica, por exemplo.
No âmbito da telemedicina, não foram identificadas barreiras concorrenciais à abordagem adotada pela UE, uma vez que as diretrizes preveem a viabilização da interoperabilidade das prescrições eletrônicas. No entanto, os Estados Unidos e o Brasil restringiam a validade destas prescrições, o que constitui uma barreira regulatória ao desenvolvimento do mercado de telemedicina nesses países, enquadrando-se no cenário A3 (limitação do número ou da variedade de fornecedores), a partir da restrição da capacidade de prestação de bens ou de serviços a certos tipos de empresas.
Com o contexto da Covid-19, houve flexibilização nas regulações dos EUA e do Brasil, o que contribuiu para a redução das barreiras regulatórias sobre o setor de telemedicina, levando assim à redução dos riscos restritivos decorrentes do instrumento de comando e controle adotado nesses países.
Referências
BRASIL. Resolução CFM nº 1.643/2002. Conselho Federal de Medicina. Publicada no D.O.U. de 24 de agosto de 2002, Seção 1, p. 205. Disponível em: <https://sistemas.cfm.org.br/normas/visualizar/resolucoes/BR/2002/1643>. Acesso em 31 de agosto de 2020.
BRASIL. Resolução CFM nº 2.227/2018. Conselho Federal de Medicina, 2019. Publicada no D.O.U. de 06 de fevereiro de 2019, Seção 1, p. 58. Disponível em: <https://sistemas.cfm.org.br/normas/visualizar/resolucoes/BR/2018/2227>. Acesso em 31 de agosto de 2020.
BRASIL. Resolução CFM nº 2.228/2019. Conselho Federal de Medicina, 2019. Publicada no D.O.U. de 06 de março de 2019, Seção 1, p. 91. Disponível em: <https://sistemas.cfm.org.br/normas/visualizar/resolucoes/BR/2019/2228>. Acesso em 31 de agosto de 2020.
BRASIL. Ofício CFM nº 1.756/2020 – COJUR. Conselho Federal de Medicina, de 19 de março de 2020. Disponível em: <https://portal.cfm.org.br/images/PDF/2020_oficio_telemedicina.pdf>. Acesso em 31 de agosto de 2020.
BRASIL. Lei nº 13.979, de 06 de fevereiro de 2020. Publicada no D.O.U. de 07 de fevereiro de 2020, Seção 1, p. 1. Disponível em: <http://www.planalto.gov.br/ccivil_03/_ato2019-2022/2020/lei/l13979.htm>. Acesso em 31 de agosto de 2020.
BRASIL. Lei nº 3.268, de 30 de setembro de 1957. Publicada no D.O.U. de 07 de fevereiro de 2020, Seção 1, p. 1. Disponível em: <http://www.planalto.gov.br/ccivil_03/leis/l3268.htm#:~:text=Art%20.,Art%20>. Acesso em 31 de agosto de 2020.
GERMAN FEDERAL MINISTRY OF HEALTH. Driving the digital transformation of Germany’s healthcare system for the good of patients. Bonn, 2019. Disponível em: <https://www.bundesgesundheitsministerium.de/digital-healthcare-act.html>. Acesso em: 11 de outubro de 2020.
GERMAN MEDICAL ASSEMBLY. Professional Code for Physicians in Germany. Erfurt, 2018. Disponível em: https://www.bundesaerztekammer.de/fileadmin/user_upload/downloads/pdf-Ordner/MBO/MBO-AE_EN_2018.pdf>. Acesso em: 20 de outubro de 2020.
MAIA, Jéssica P.; MONTE REY, Kamyle M. Análise de Impacto Concorrencial sobre os instrumentos regulatórios da telemedicina no contexto do Covid-19: Brasil, União Europeia e Estados Unidos. Direito Econômico e Defesa da Concorrência. Volume 03 – Coletânea de Artigos em Defesa da Concorrência e Direito Econômico: Mercado Médico-Hospitalar e Economia Digital. Conselho Administrativo de Defesa Econômica. 2021. pp. 187
OECD. Guia para Avaliação de Concorrência Volume 3 – Manual Operacional. Versão 3.0. 2017. Disponível em: <http://www.oecd.org/daf/competition/operational-manual-for-competition-assessment-PT.pdf>.Acesso em 26 de agosto de 2020.
PARLAMENTO EUROPEU. Directiva 95/46/CE do Parlamento Europeu e do Conselho, de 24 de Outubro de 1995, relativa à protecção das pessoas singulares no que diz respeito ao tratamento de dados pessoais e à livre circulação desses dados. Bruxelas, 1995. Disponível em: <https://eur-lex.europa.eu/legal-content/PT/TXT/?uri=celex%3A31995L0046>. Acesso em 27 de outubro de 2020.
PARLAMENTO EUROPEU. Directive 2000/31/EC of the European Parliament and of the Council of 8 June 2000 on certain legal aspects of information society services, in particular electronic commerce, in the Internal Market: Directive on electronic commerce. Bruxelas, 2000. Disponível em: <https://eur-lex.europa.eu/eli/dir/2000/31/oj>. Acesso em: 30 de outubro de 2020.
PARLAMENTO EUROPEU. Directiva 2011/24/UE do Parlamento Europeu e do Conselho, de 9 de março de 2011, relativa ao exercício dos direitos dos doentes em matéria de cuidados de saúde transfronteiriços. Bruxelas, 2011. Disponível em: <https://eur-lex.europa.eu/legal-content/PT/TXT/?uri=CELEX%3A32011L0024&qid=1604335159578>. Acesso em: 25 de outubro de 2020.
PARLAMENTO EUROPEU. Diretiva (UE) 2016/1148 do Parlamento Europeu e do conselho relativa a medidas destinadas a garantir um elevado nível comum de segurança das redes e da informação em toda a União Europeia. Bruxelas, 2016. Disponível em: <https://eur-lex.europa.eu/legal-content/PT/TXT/PDF/?uri=CELEX:32016L1148&from=LT>. Acesso em 20 de agosto de 2020.
REPÚBLICA FRANCESA. Décret n° 2010-1229 du 19 octobre 2010 relatif à la télémédecine. Paris, 2010. Disponível em: < https://www.legifrance.gouv.fr/jorf/id/JORFTEXT000022932449/>. Acesso em 20 de outubro de 2020.
REPÚBLICA FRANCESA. Décret n° 2020-227 du 9 mars 2020: adaptant les conditions du bénéfice des prestations en espèces d’assurance maladie et de prise en charge des actes de télémédecine pour les personnes exposées au covid-19. Paris, 2020. Disponível em: <https://www.legifrance.gouv.fr/jorf/id/JORFTEXT000041704122/>. Acesso em: 21 de outubro de 2020.
REPÚBLICA ITALIANA. Decreto Legislativo 30 dicembre 1992, n. 502. Roma, 1992. Disponível em: <http://www.anaao.it/userfiles/DLgs_502_92.pdf>. Acesso em: 14 de outubro de 2020.
* Jéssica Portal Maia é consultora interna da GO Associados.
** Kamyle Medina Monte Rey é economista da Coordenação-Geral de Pesquisa da Escola Nacional de Administração Pública (Enap).
